Interactive Q & A
To open or close an answer please click on the question! All questions are available in English (EN), French (FR), German (DE), Spanish (ES), Dutch (NL), Hungarian (HU) and Danish (DK). What do you want to know about MICROB-PREDICT? Send us your questions!
-
Cirrhosis is sometimes called end stage liver disease. This simply means that it occurs after other stages of liver damage which can include inflammation (hepatitis), fatty deposits (steatosis), and increased stiffness and mild-scarring of the liver (fibrosis). Such liver damage can be due to alcoholism, infections, unhealthy live style, bad nutrition or eating habits, severe injury, or other causes. That’s why it is so important to avoid any liver damage in the first place and to do everything to keep your liver healthy and functional. Liver means life, and you only have one of each!
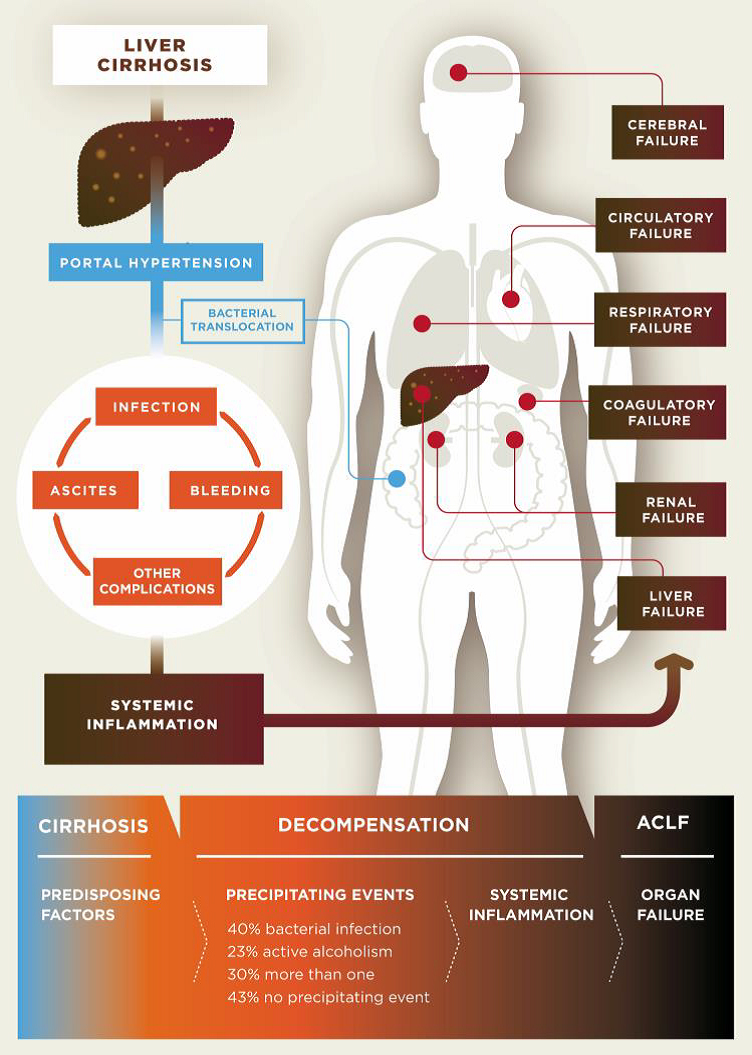
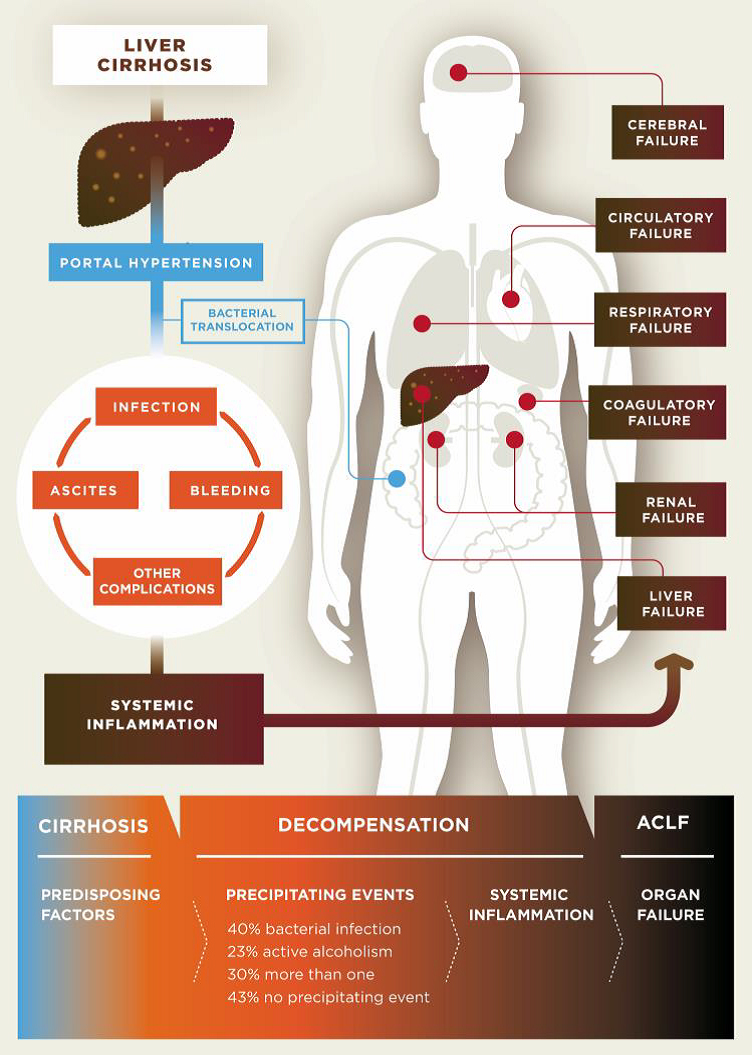
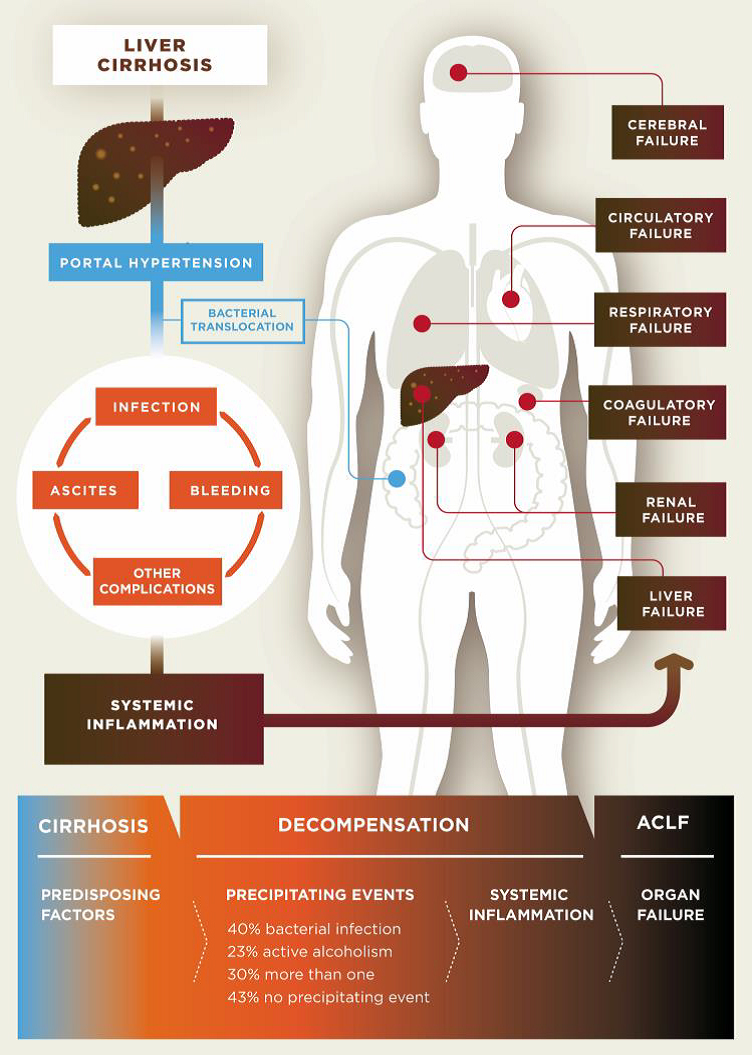
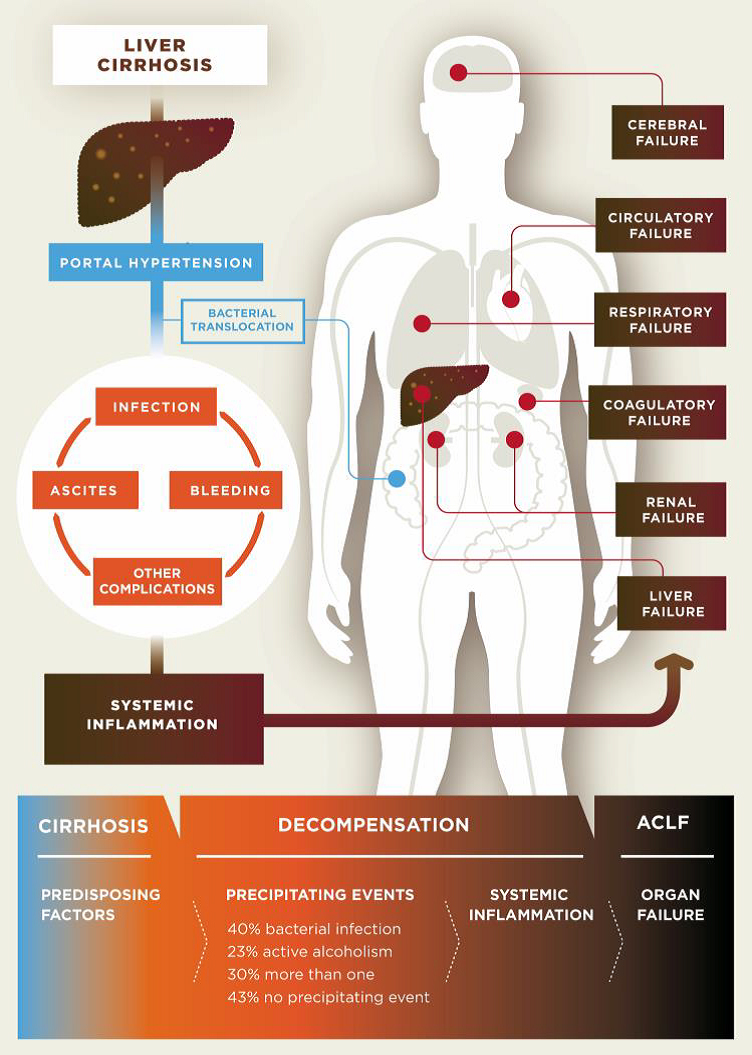
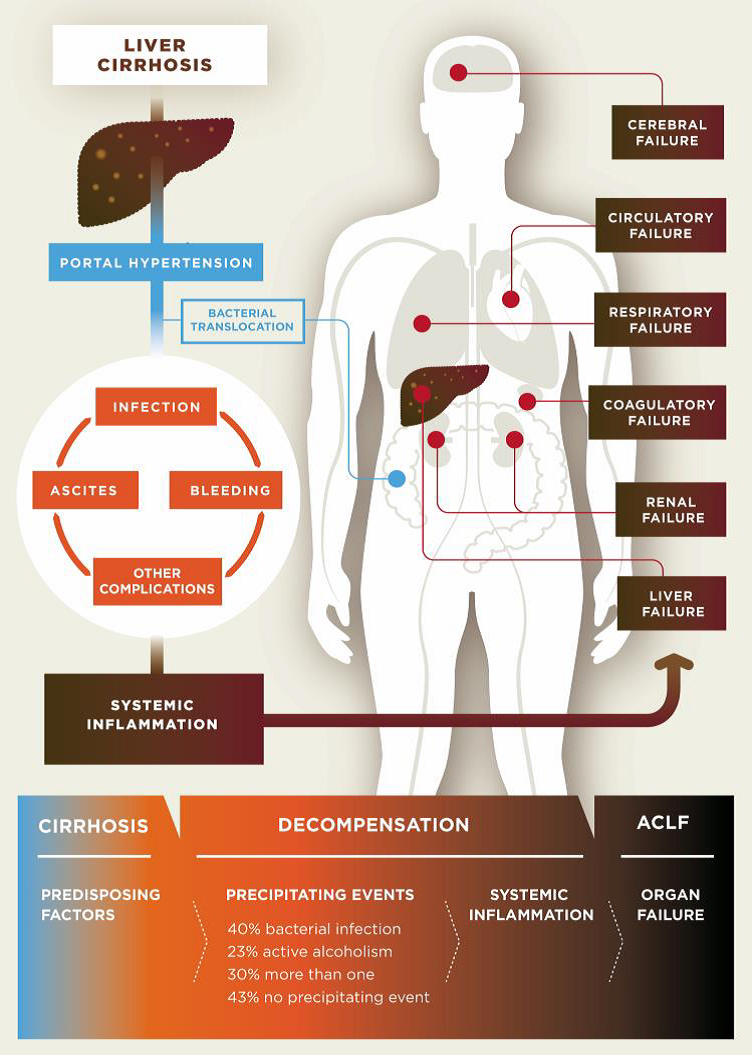
Cirrhosis is classified as compensated or decompensated. Compensated cirrhosis is where the liver is coping with the damage and maintaining its important functions. Many people with compensated cirrhosis can feel quite well and live for many years without needing a liver transplant. Until a certain point, the liver can function relatively well even when it is quite severely damaged. Any further damage to the liver may be lethal though. In decompensated cirrhosis, the liver is not able to perform all its functions adequately. People with decompensated cirrhosis often suffer from serious symptoms and complications such as portal hypertension (high blood pressure within the vessel system travelling through the liver), bleeding varices (life-threatening bleeding from blood vessels in the oesophagus or stomach), ascites (accumulation of fluids in the belly, more specifically in the peritoneal cavity), severe infections, encephalopathy (cerebral failure), eventually leading to acute-on-chronic liver failure (ACLF), followed by multi-organ failure and death.

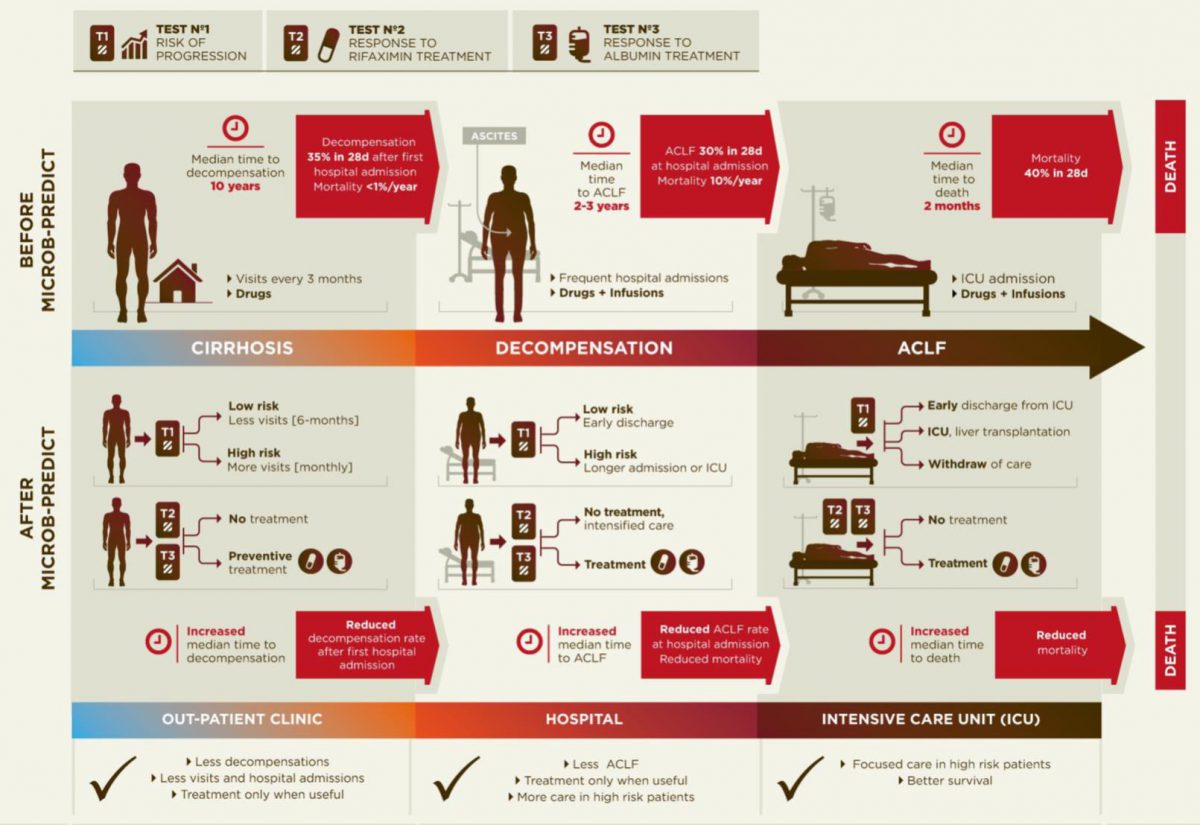
Pathogenesis of decompensated liver cirrhosis and the progression from decompensation to acute-on-chronic liver failure (ACLF).
-
The gut microbiome represents the largest pool of genetic material in the body with high metabolic activity. Most microbes live in symbiosis with our body, meaning we need them to help us digest and absorb our food properly. Each human being harbours at least 40 billion (4 x 1013) living microbial cells. In healthy conditions, the human (here also called the “host”) tightly regulates the gut microbiome, its distribution, composition, and activity by secretion of bile acids and antibacterial peptides. This ensures that an ideal balance of “just enough microbes” is maintained. By now, there is sufficient evidence that changes in microbiome might modify and even halt the progression of liver disease and that – compared to healthy controls – profound differences in the microbiome are present in liver cirrhosis, the final stage of all chronic liver diseases. However, the dynamics and mechanisms are not yet fully explored.
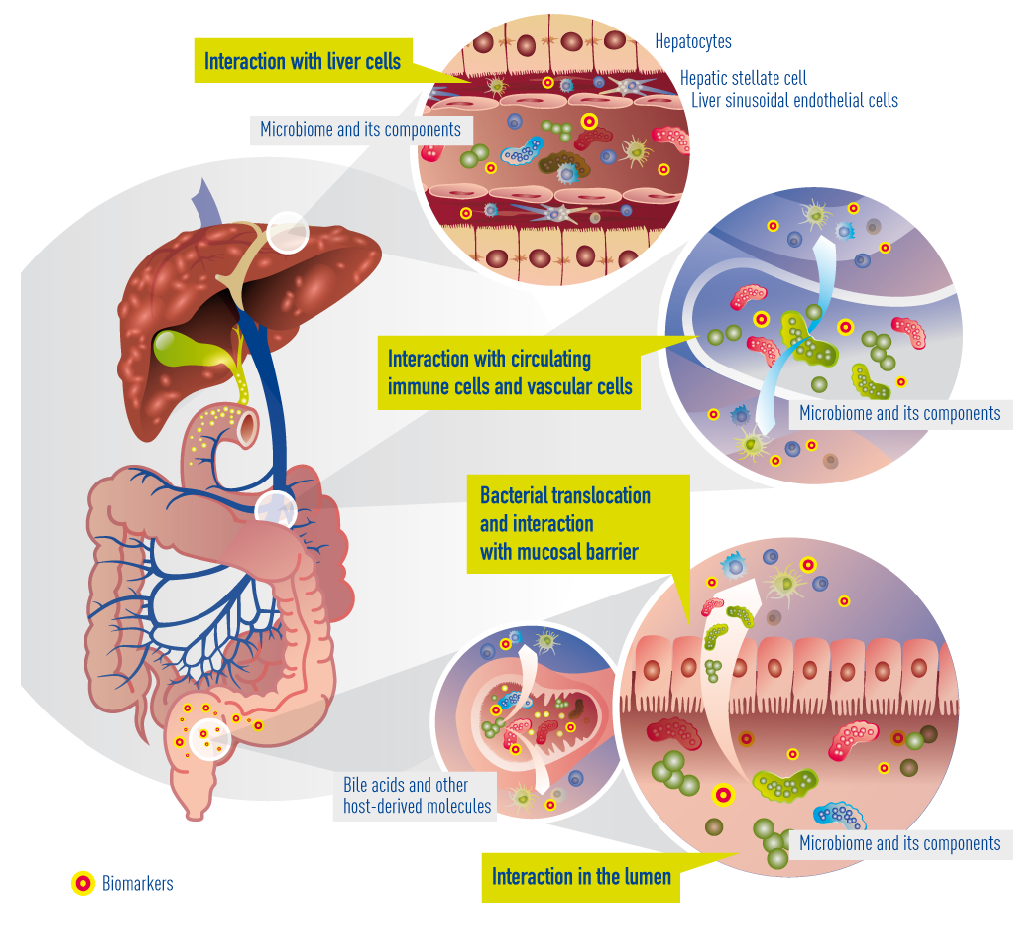
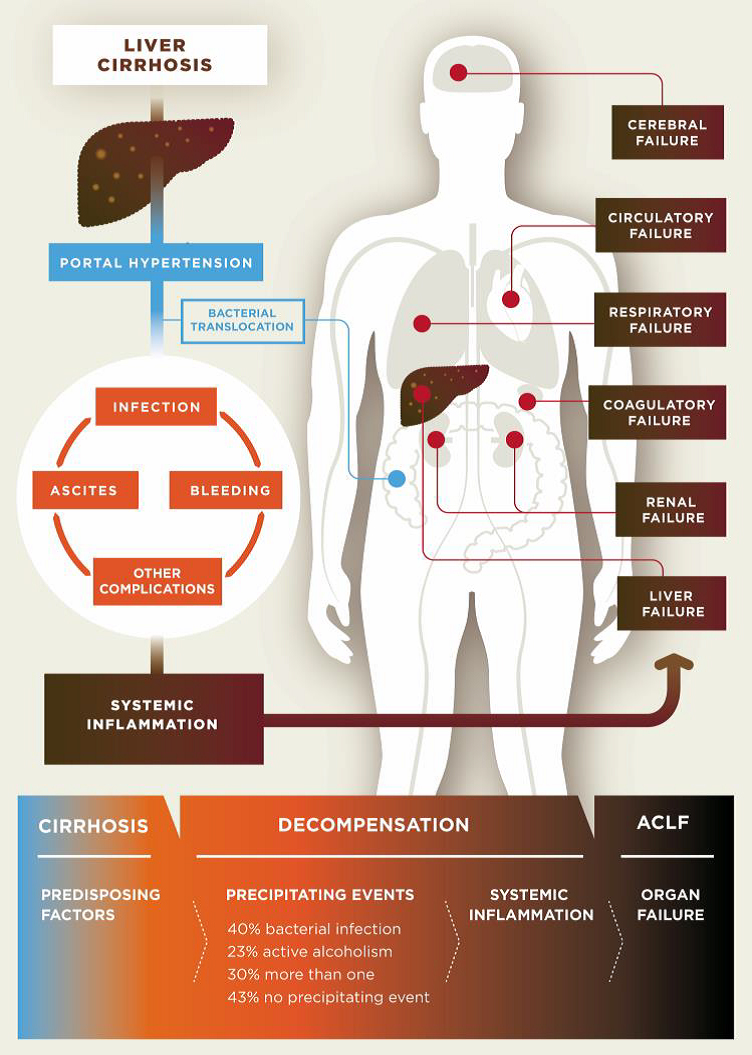
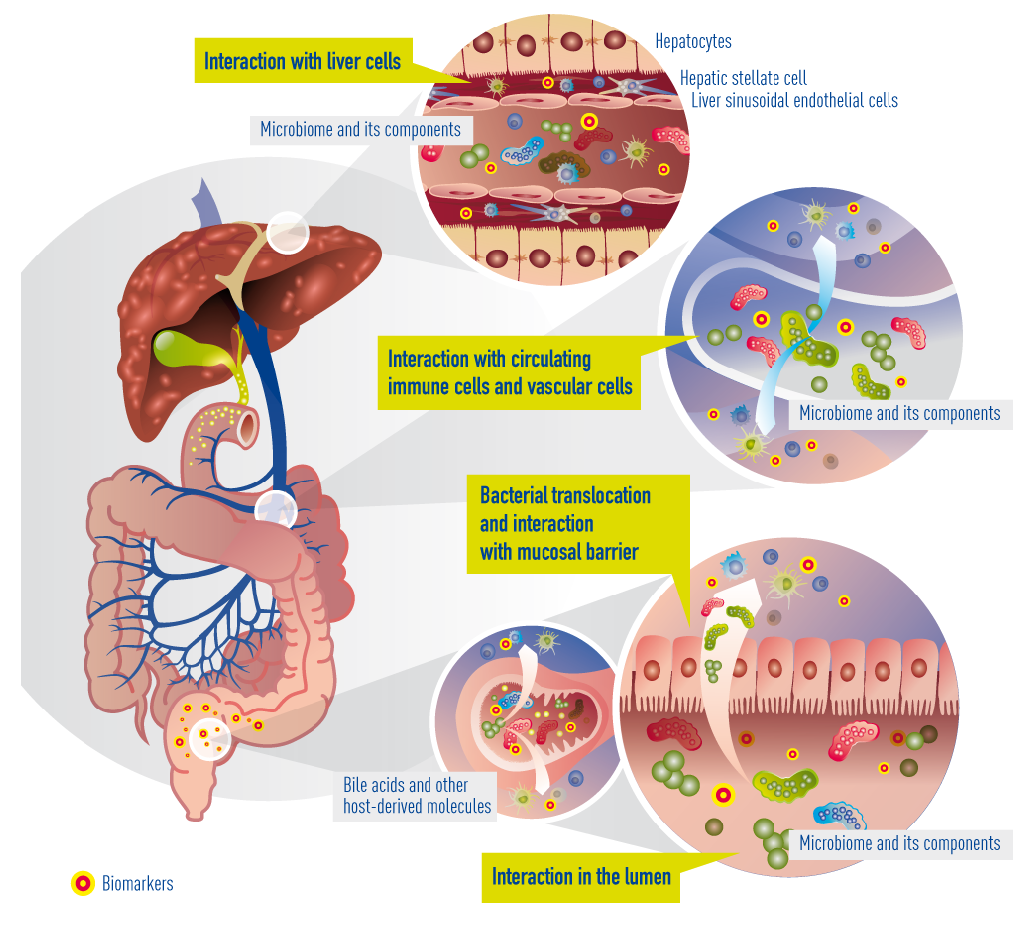
In cirrhosis, the epithelial barrier of the gut has become quite damaged, resulting in a so called “leaky gut”. This means that bacteria and their metabolites can now enter the portal blood circulation (a process called “bacterial translocation”) to interact with immune cells, interact with vascular cells, reach the liver, and interact with liver cells (hepatocytes). Within cirrhotic patients, a subgroup experience deterioration of their underlying cirrhosis, called decompensation episodes, usually requiring hospital admission. In 30% of these patients, the clinical situation deteriorates further and acute-on-chronic liver failure (ACLF) occurs. The progression from decompensation to ACLF is reflected in an extensive activation of systemic inflammation, affecting many cytokines and inflammatory systems. It is likely that bacterial translocation leads to this burst of inflammation. More often than not decompensation and ACLF develop without identifiable precipitating events, suggesting that endogenous mechanisms, e.g. translocation of detrimental bacteria, are involved.


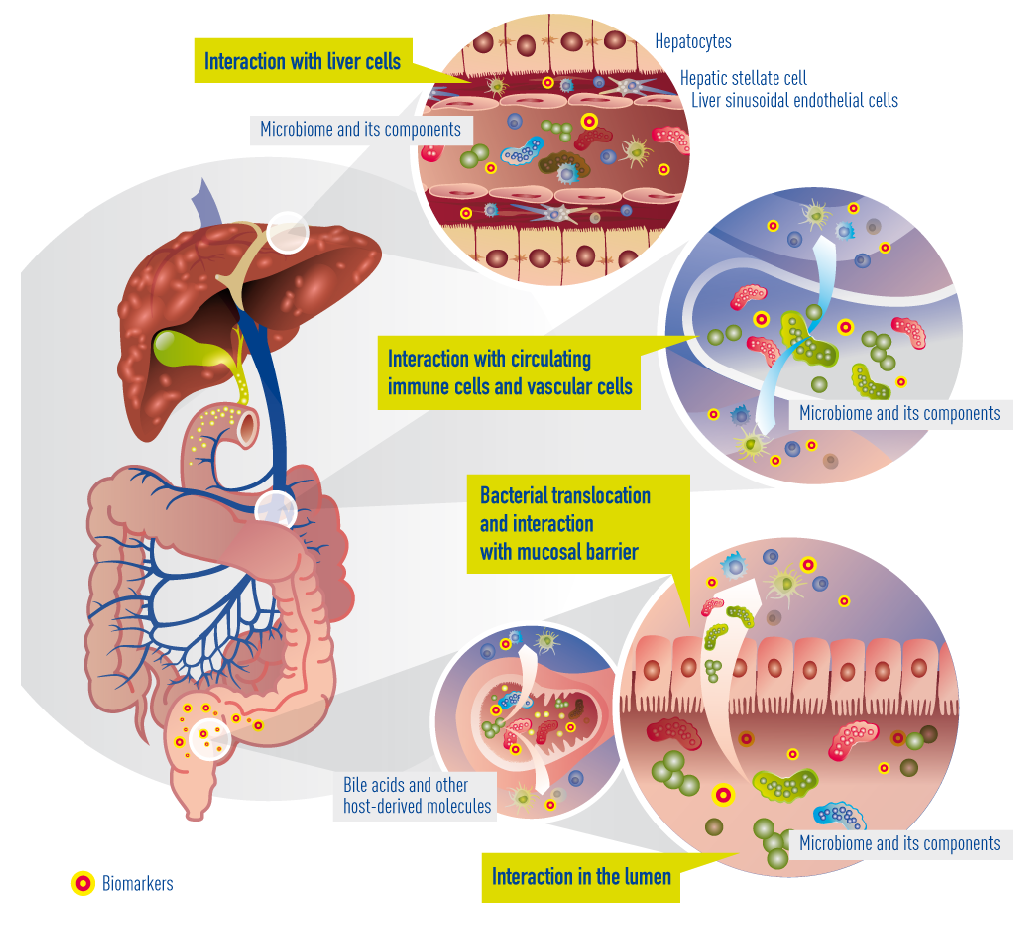
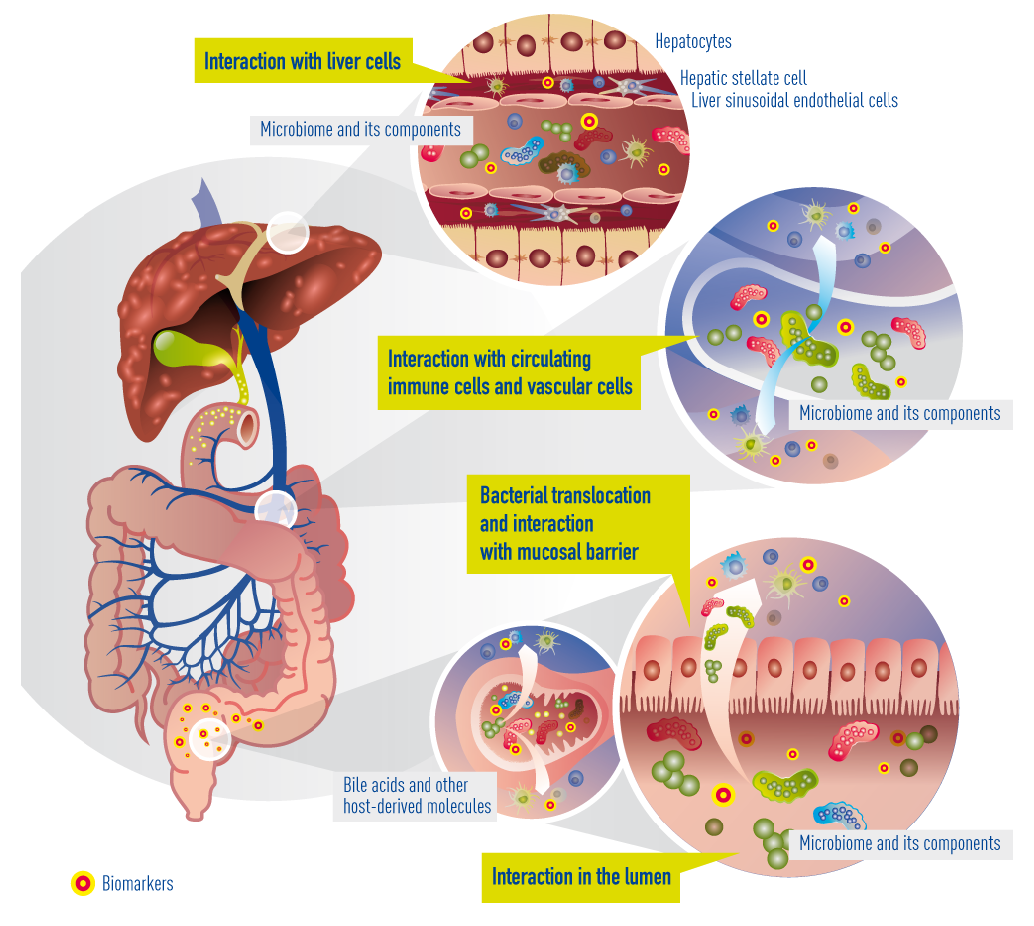
Currently known and suggested gut-liver interactions in cirrhosis. Impaired epithelial barrier (“leaky gut”) allows bacteria or bacterial products (metabolites) to translocate into the blood circulation and reach the liver. There, they interact with circulating and resident immune cells and liver cells. Concomitantly, bile acids and other molecules (e.g. antibacterial peptides) originating from the liver arbitrate between liver and gut microbiota.
-
- Integration of existing clinical, laboratory, microbiome and multi-omics data from 12 cohorts, combining more than 200,000 data points from more than 10,000 subjects
- Development of microbiome-based tests for better stratification of cirrhosis patients leading to personalized prediction and prevention of decompensation and ACLF and more personalized allocation to treatment
- Validation of new microbiome-based markers in a clinical trial to enable prediction of response and thereby optimization of Rifaximin or albumin treatment
- Design of modern, effective nanobiosensors as useful clinical tools to set the foundation for personalized therapy
- Involvement of world-leading microbiome specialists, technology leaders and clinical experts for scientific excellence, the European Liver Patients Association (ELPA) and the European Association for the study of the Liver (EASL)
-
- Improved specificity of diagnostic tools
- Better prediction and thereby prevention of decompensation and ACLF
- Stratifying and personalizing the treatment of decompensated liver cirrhosis and ACLF
- Increasing survival and decreasing health care burden
- Novel diagnostic and therapeutic approaches to stimulate innovation in the European healthcare industry


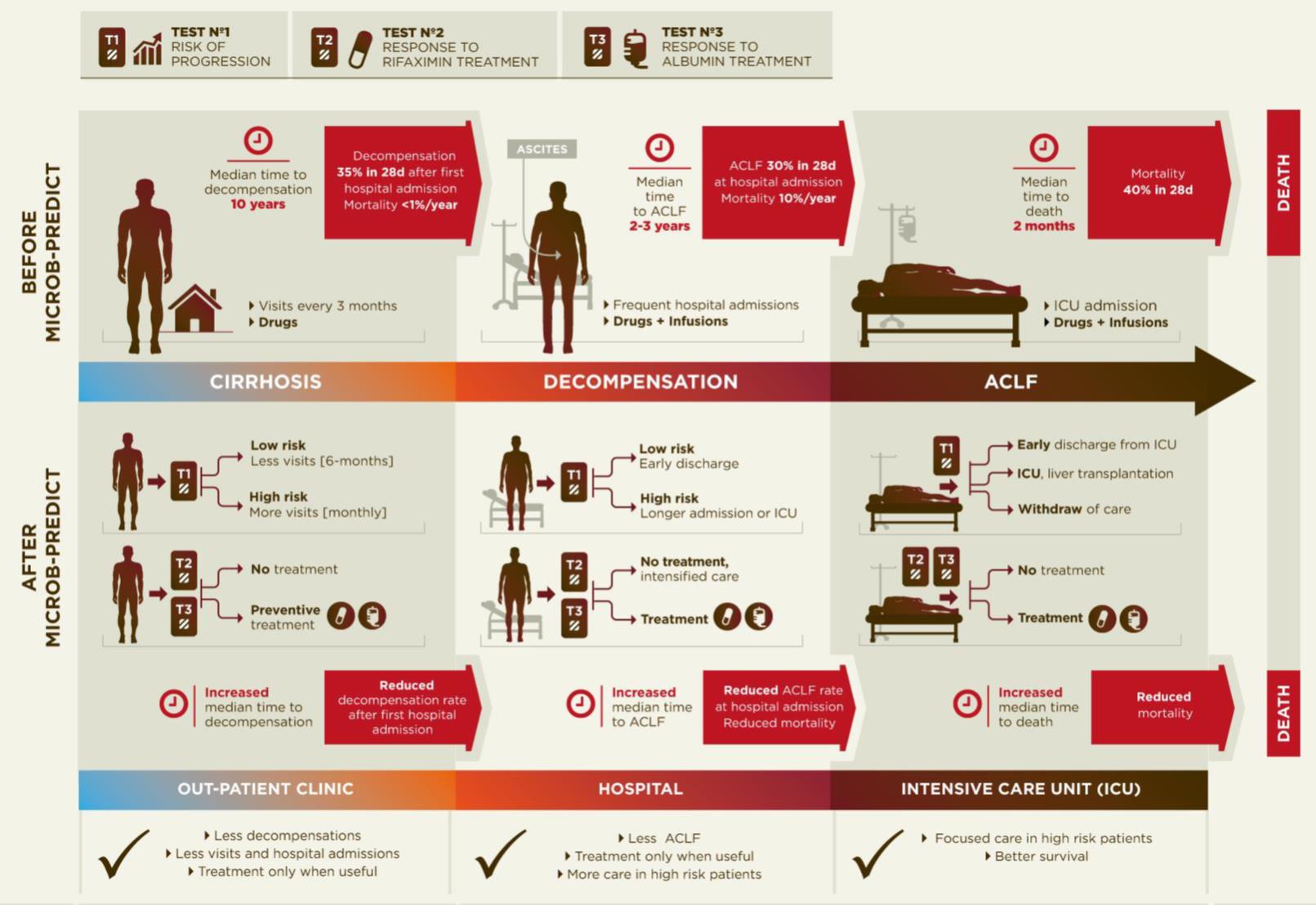
Diagram of the current disease progression (upper panel) versus personalized medicine applying the results from MICROB-PREDICT (lower panel).
-
La cirrhose est parfois appelée maladie du foie au stade terminal. Cela signifie simplement qu’elle survient après d’autres stades de lésions hépatiques qui peuvent inclure une inflammation (hépatite), des dépôts graisseux (stéatose), une perte de souplesse et des marques de cicatrisation du foie (fibrose). De telles lésions hépatiques peuvent être dues à l’alcoolisme, aux infections, à l’hygiène de vie, à une mauvaise alimentation ou à de mauvaises habitudes alimentaires, à des blessures graves ou à d’autres causes. C’est pourquoi il est important d’éviter de garder un foie sain et fonctionnel. Le foie, c’est la vie, et vous n’en avez qu’un!
La cirrhose peut être compensée ou décompensée. Dans la cirrhose compensée, le foie fait face aux lésions et maintient ses fonctions principales. De nombreuses personnes atteintes d’une cirrhose compensée peuvent se sentir très bien et vivre de nombreuses années sans avoir besoin d’une greffe du foie. Jusqu’à un certain point, le foie peut fonctionner relativement bien, même lorsqu’il est très gravement endommagé. Cependant, toute autre altération hépatique supplémentaire peut être mortelle. Dans la cirrhose décompensée, le foie n’est pas en mesure de remplir toutes ses fonctions de façon adéquate. Les personnes atteintes de cirrhose décompensée souffrent souvent de symptômes et de complications graves tels que l’hypertension portale (hypertension de la veine porte traversant le foie), les hémorragies digestives (saignements au niveau des vaisseaux sanguins de l’œsophage ou de l’estomac et mettant la vie en danger), les ascites (accumulation de liquides dans le ventre, plus spécifiquement dans la cavité péritonéale), les infections graves, les encéphalopathies (défaillance cérébrale) pouvant mener à l’insuffisance hépatique chronique, suivie d’une défaillance multi-organes et de la mort.

 Pathogenèse de la décompensation d’une cirrhose du foie et de l'ACLF.
Pathogenèse de la décompensation d’une cirrhose du foie et de l'ACLF. -
Le microbiome intestinal représente le plus grand réservoir de matériel génétique de l’organisme avec une activité métabolique élevée. La plupart des microbes vivent en symbiose avec notre corps, ce qui signifie que nous avons besoin d’eux pour nous aider à digérer et absorber notre nourriture correctement. Chaque être humain abrite au moins 40 mille de milliards (4 x 1013) de cellules microbiennes vivantes. Dans des conditions normales, l’homme (ici appelé “hôte”) régule étroitement le microbiome intestinal, sa distribution, sa composition et son activité via la sécrétion d’acides biliaires et de peptides antibactériens. Ceci permet de maintenir un équilibre idéal en termes de nombre de microbes. À ce jour, il y a suffisamment de preuves qui indiquent que des changements dans le microbiome pourraient modifier et même arrêter la progression des maladies du foie, et que, comparativement aux individus sains, il existe de grandes différences de composition du microbiome dans la cirrhose du foie, l’étape finale de toutes les maladies chroniques du foie. Cependant, la dynamique et les mécanismes n’en sont pas encore pleinement explorés.
Dans la cirrhose, la barrière épithéliale de l’intestin est très endommagée, ce qui entraîne une “fuite intestinale”. Cela signifie que les bactéries et leurs métabolites peuvent maintenant pénétrer dans la circulation sanguine portale (un processus appelé “translocation bactérienne”) pour interagir avec les cellules immunitaires, les cellules vasculaires, le foie et les cellules hépatiques (hépatocytes). Chez les patients cirrhotiques, un sous-groupe subit une détérioration de leur cirrhose sous-jacente, appelée épisodes de décompensation, nécessitant habituellement une hospitalisation. Chez 30 % de ces patients, la situation clinique se détériore davantage et l’insuffisance hépatique aiguë sur chronique (« ACLF », de l’anglais « Acute on Chronic Liver Failure ») survient. La progression de la décompensation à l’ACLF se traduit par une activation étendue de l’inflammation systémique, affectant de nombreuses cytokines et systèmes inflammatoires. Il est probable que la translocation bactérienne entraîne cette poussée d’inflammation. Le plus souvent, la décompensation et l’ACLF se développent sans événements déclencheurs identifiables, ce qui suggère que des mécanismes endogènes, par exemple la translocation de bactéries nuisibles, sont impliqués.

Interactions intestin-foie actuellement connues et suggérées dans la cirrhose. L'altération de la barrière épithéliale ("intestin qui fuit") permet aux bactéries ou aux produits bactériens (métabolites) d’atteindre la circulation sanguine et ensuite le foie. Là, ils interagissent avec les cellules immunitaires et les cellules hépatiques circulantes et résidentes. En même temps, les acides biliaires et d'autres molécules (par ex. les peptides antibactériens) provenant du foie jouent un rôle de médiateur entre le foie et le microbiote intestinal.
-
- Intégration des données cliniques, de laboratoire, du microbiome et multi-omiques existantes provenant de 12 cohortes, combinant plus de 200 000 points de données provenant de plus de 10 000 sujets.
- Développement de tests issus de l’analyse du microbiome intestinal pour une meilleure stratification des patients atteints de cirrhose permettant une prédiction et une prévention personnalisées de la décompensation et de l’ACLF et un traitement plus personnalisé.
- Validation dans un essai clinique de nouveaux marqueurs provenant de l’analyse du microbiome intestinal pour permettre la prédiction de la réponse et donc l’optimisation du traitement par la rifaximine ou l’albumine.
- Conception de nanobiocapteurs modernes et efficaces comme outils cliniques utiles pour poser les bases d’une thérapie personnalisée.
- Implication des meilleurs spécialistes mondiaux des microbiomes, des leaders technologiques et des experts cliniques pour l’excellence scientifique, l’association européenne des patients atteints de maladies du foie (« ELPA », de l’anglais « European Liver Patients Association ») et l’Association européenne pour l’étude du foie (« EASL », de l’anglais « European Association for the study of the Liver »).
-
- Amélioration de la spécificité des outils de diagnostic
- Meilleure prédiction et donc prévention de la décompensation et de l’ACLF
- Stratification et personnalisation du traitement de la cirrhose hépatique décompensée et de l’ACLF
- Augmentation de la survie et diminution de la charge du coût de prise en charge des patients
- Nouvelles approches diagnostiques et thérapeutiques pour stimuler l’innovation au sein de l’industrie européenne des soins de santé

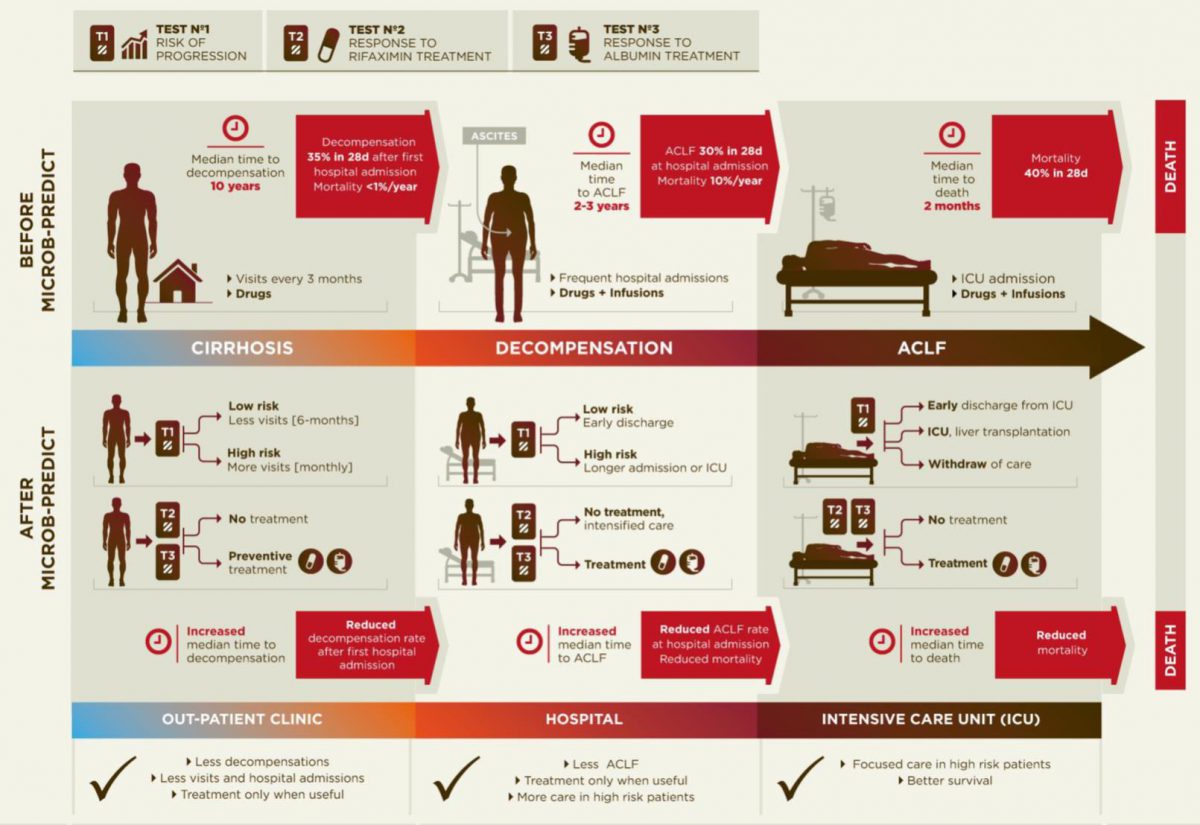
Diagramme schématisant la progression de la maladie du foie basée sur les connaissances actuelles (panneau supérieur), et sur la médecine personnalisée en utilisant les résultats de MICROB-PREDICT (panneau inférieur).
-
Zirrhose ist das Endstadium der Lebererkrankung. Das bedeutet, dass der Zirrhose andere Stadien der Leberschädigung vorausgehen, wie z.B. Entzündung (Hepatitis), Fettablagerungen (Steatose), sowie Verhärtung und Narbenbildung im Lebergewebe (Fibrose). Solche Leberschädigungen können aufgrund von Alkoholismus, Infektionen, ungesundem Lebensstil, schlechter Ernährung oder schädlicher Essgewohnheiten, schweren Verletzungen oder aus anderen Gründen auftreten. Deshalb ist es wichtig, Leberschädigungen zu vermeiden und alles zu tun, um die Leber gesund und funktionsfähig zu halten. Die Leber ist ein lebenswichtiges Organ und wir haben nur eine davon!
Man unterteilt die Zirrhose in kompensierte und dekompensierte Zirrhose. Bei der kompensierten Zirrhose wird die Schädigung noch ausgeglichen, und die Leber behält ihre wichtigen Funktionen bei. Viele Menschen mit kompensierter Zirrhose fühlen sich durchaus noch ganz gut und leben noch viele Jahre ohne den Bedarf einer Lebertransplantation. Bis zu einem gewissen Punkt ist die Funktion der Leber noch ausreichend, auch wenn sie schon schwer geschädigt ist. Eine Schädigung über diesen Punkt hinaus jedoch kann zum Tode führen. In der dekompensierten Zirrhose ist die Leber nicht mehr im Stande all ihre Funktionen adäquat auszuführen. Menschen mit dekompensierter Zirrhose leiden an schwerwiegenden Symptomen und Komplikationen, wie z.B. portaler Hypertension (Bluthochdruck und Stauung des Bluts im Blutgefäßsystem, das sich durch die Leber zieht), lebensbedrohliche Blutungen der Blutgefäßen der Speiseröhre oder des Magens, Aszites (Ansammlung von Wasser in der Bauchfellhöhle), schweren Infektionen, leberbedingte Hirnschädigung (hepatische Enzephalopathie), die letztendlich zu akut-auf-chronischem Leberversagen (ACLF), Multiorganversagen und zum Tod führen können.

Entstehung der Dekompensation in der Zirrhose bis hin zum akut-auf-chronischen Leberversagen (ACLF).
-
Die Darmflora stellt den größten Pool an Genmaterial im Körper mit hoher Stoffwechselaktivität dar. Die meisten Mikroben leben in Symbiose mit unserem Körper, d.h. wir brauchen sie, damit sie uns bei der Verdauung und Nahrungsaufnahme helfen. Jeder Mensch beherbergt mindestens 40 Milliarden (4×1013) lebende Mikroben. In gesundem Zustand reguliert der menschliche Körper (in diesem Zusammenhang auch „Wirt“ genannt) die Darmflora, ihre Verteilung, Zusammensetzung und Aktivität durch Ausschüttung von Gallensäure und antibakteriellen Peptiden. Dadurch wird bei gesunden Menschen eine ideale Balance der benötigten Mikroben aufrechterhalten. Es gibt bereits ausreichende Beweise dafür, dass Veränderungen der Darmflora den Verlauf einer Lebererkrankung beeinflussen und deren Voranschreiten aufhalten können. Des Weiteren ist bekannt, dass es schwerwiegende Unterschiede zwischen dem Mikrobiom von gesunden Menschen und dem von Menschen mit Zirrhose, dem Endzustand aller chronischen Lebererkrankungen, gibt. Die dahinterliegende Dynamik und Mechanismen sind jedoch noch nicht vollständig erforscht.
Bei der Zirrhose ist die Epithelbarriere des Darms, also die Darmwand, recht stark geschädigt, was zu erhöhter Durchlässigkeit führt. Dies bedeutet, dass Bakterien und ihre Stoffwechselprodukte in den Blutkreislauf eindringen können (sog. bakterielle Translokation) und dort mit Immun- und Blutzellen interagieren, die Leber erreichen und dort mit Leberzellen (Hepatozyten) in Kontakt kommen. Bei den Zirrhosepatienten gibt es eine Untergruppe, die eine Verschlechterung der Zirrhose erlebt, sog. Dekompensationsepisoden, die üblicherweise einen Krankenhausaufenthalt erforderlich machen. Bei 30% dieser Patienten verschlechtert sich das Gesundheitsbild weiter und das akut-auf-chronische Leberversagen (ACLF) tritt auf. Das Voranschreiten von der Dekompensation zum ACLF zeigt sich in einer weitreichenden Aktivierung systemischer Entzündungsprozesse, die Einfluss auf viele Zytokine (also Proteine, die das Wachstum und die Differenzierung von Zellen regulieren) und Entzündungssysteme haben. Es ist wahrscheinlich, dass das Eindringen von Bakterien in den Blutkreislauf die genannten Entzündungen auslöst. Dekompensation und ACLF treten häufig ohne feststellbare Vorereignisse auf, was darauf hindeutet, dass Mechanismen im Körperinneren, z.B. ein Übertritt von Bakterien in andere Körperbereiche, dafür verantwortlich sind.

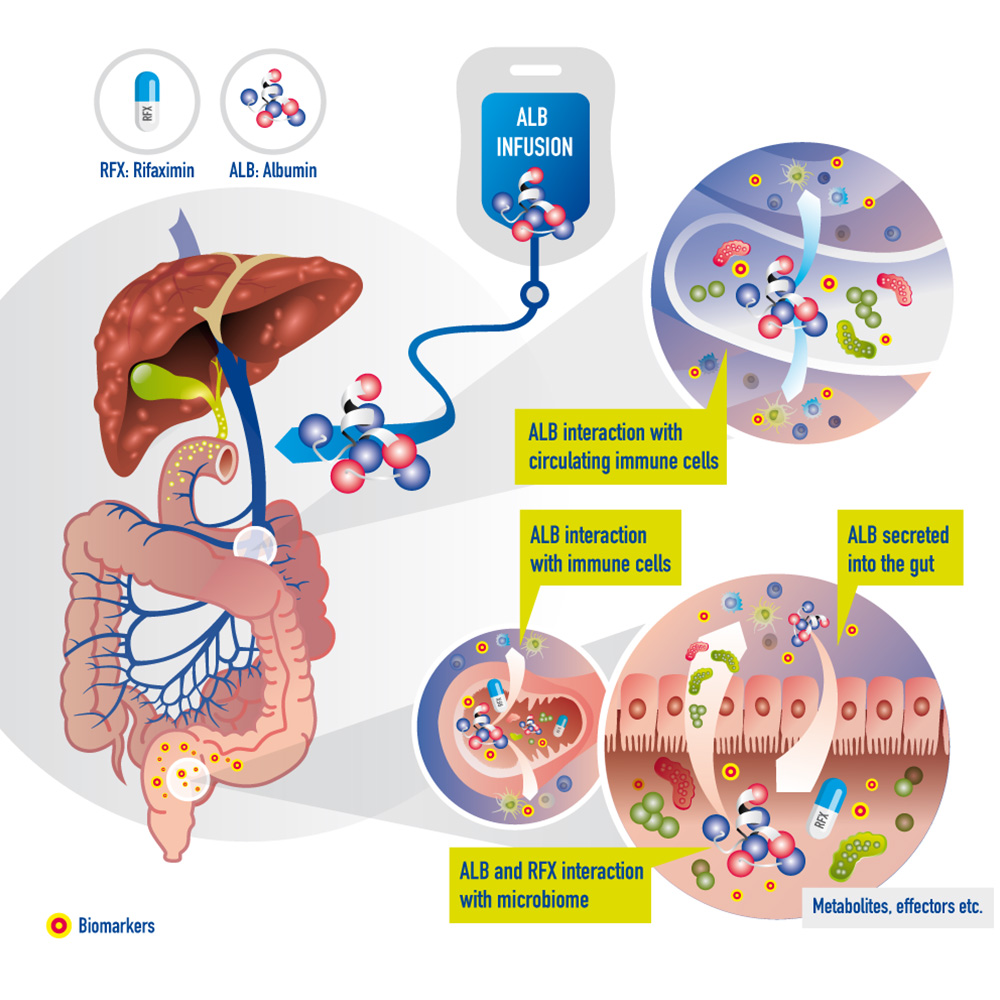
Die Grafik zeigt die Interaktion von Rifaximin und humanem Albumin mit dem Darm und den dort enthaltenen Mikroorganismen in der Zirrhose. Rifaximin wird oral verabreicht, während humanes Albumin durch eine Infusion direkt ins Blut gelangt und von dort in den Darm ausgeschieden wird. Indikatoren im Mikrobiom könnten die Wirkung dieser Behandlung frühzeitig vorhersagen.
-
- Integration bereits vorhandener Daten aus Klinik, Labor, Mikrobiom und weitere Techniken der modernen Biologie von 12 Kohorten mit über 200.000 Datenpunkten von mehr als 10.000 Probanden
- Entwicklung mikrobiom-basierter Tests, die eine individuellere („personalisierte“) Vorhersage von Dekompensation und ACLF ermöglichen und damit zur Vermeidung und gezielteren Behandlungsstrategien beitragen sollen
- Validierung neuer mikrobiom-basierter Marker in einer klinischen Studie, um den Erfolg einer Behandlung mit Rifaximin und Albumin vorhersagen und den Behandlungserfolg damit optimieren zu können
- Entwicklung und Test von modernen und wirksamen Nanobiosensoren als hilfreiche klinische Instrumente als Grundlage einer stärker personalisierten Therapie
- Zusammenarbeit von weltweit führenden Mikrobiomexperten, Technologieführern, und spezialisierten Ärzten zum Aufbau eines exzellenten Wissenschaftsclusters, sowie der Europäischen Leberpatientenvereinigung (ELPA) und der Europäischen Vereinigung für Erforschung der Leber (EASL)
-
- Verbesserte Genauigkeit der diagnostischen Methoden
- Bessere Vorhersage und hierdurch Vermeidung von Dekompensation und ACLF
- Gezieltere und individuellere Behandlungsauswahl bei dekompensierter Zirrhose und ACLF
- Erhöhung der Überlebenschance von Patienten
- Verminderung der Kosten für das Gesundheitssystem
- Neuartige diagnostische und therapeutische Ansätze zur Stimulation von Innovationen in der Europäischen Gesundheitsindustrie

 Überblick über den derzeit üblichen Krankheitsverlauf (oberer Abschnitt) und neue, personalisierte Behandlungs-Ansätze unter Anwendung der Ergebnisse des MICROB-PREDICT Projektes (unterer Abschnitt)
Überblick über den derzeit üblichen Krankheitsverlauf (oberer Abschnitt) und neue, personalisierte Behandlungs-Ansätze unter Anwendung der Ergebnisse des MICROB-PREDICT Projektes (unterer Abschnitt) -
La cirrosis a veces se denomina enfermedad hepática en etapa terminal. Esto simplemente significa que ocurre después de otras etapas de daño hepático que pueden incluir inflamación (hepatitis), depósitos de grasa (esteatosis) y aumento de la rigidez y cicatrización leve del hígado (fibrosis). Tal grado de daño hepático puede deberse a alcoholismo, infecciones, estilo de vida poco saludable, mala nutrición o hábitos alimenticios, lesiones graves u otras causas. Por eso es tan importante evitar cualquier daño hepático en primer lugar y hacer todo lo posible para mantener su hígado sano y funcional. El hígado significa vida, ¡y solo tienes uno!
La cirrosis se clasifica en compensada o descompensada. La cirrosis compensada es cuando el hígado hace frente al daño y mantiene sus funciones importantes. Muchas personas con cirrosis compensada pueden sentirse bastante bien y vivir muchos años sin necesitar un trasplante de hígado. Hasta cierto punto, el hígado puede funcionar relativamente bien incluso cuando está muy dañado. Sin embargo, cualquier daño adicional al hígado puede ser letal. En la cirrosis descompensada, el hígado no puede realizar todas sus funciones de manera adecuada. Las personas con cirrosis descompensada a menudo padecen síntomas y complicaciones graves, como hipertensión portal (presión arterial alta dentro del sistema de vasos que viaja a través del hígado), varices hemorrágicas (hemorragia potencialmente mortal de los vasos sanguíneos del esófago o el estómago), ascitis (acumulación de líquidos en el vientre, más específicamente en la cavidad peritoneal), infecciones severas, encefalopatía (insuficiencia cerebral), eventualmente conduciendo a insuficiencia hepática aguda sobre crónica (ACLF), seguida de fallo multiorgánico y muerte.

 Patogenia de la cirrosis hepática descompensada y progresión de la descompensación a insuficiencia hepática aguda sobre crónica (ACLF).
Patogenia de la cirrosis hepática descompensada y progresión de la descompensación a insuficiencia hepática aguda sobre crónica (ACLF). -
El microbioma intestinal representa la mayor reserva de material genético del cuerpo con alta actividad metabólica. La mayoría de los microbios viven en simbiosis con nuestro cuerpo, lo que significa que los necesitamos para ayudarnos a digerir y absorber nuestros alimentos adecuadamente. Cada ser humano alberga al menos 40 mil millones (4×1013) células microbianas vivas. En condiciones saludables, el ser humano (aquí también llamado el “huésped”) regula estrechamente el microbioma intestinal, su distribución, composición y actividad mediante la secreción de ácidos biliares y péptidos antibacterianos. Esto asegura que se mantenga un equilibrio ideal de “suficientes microbios”. Por ahora, hay suficiente evidencia de que los cambios en el microbioma podrían modificar e incluso detener la progresión de la enfermedad hepática y que, en comparación con los controles sanos, existen profundas diferencias en el microbioma en la cirrosis hepática, la etapa final de todas las enfermedades hepáticas crónicas. Sin embargo, la dinámica y los mecanismos aún no se han explorado completamente.
En la cirrosis, la barrera epitelial del intestino está bastante dañada, lo que resulta en el llamado “intestino permeable”. Esto significa que las bacterias y sus metabolitos ahora pueden acceder a la circulación sanguínea portal (un proceso llamado “translocación bacteriana”) para interactuar con las células inmunitarias, interactuar con las células vasculares, llegar al hígado e interactuar con las células del hígado (hepatocitos). Dentro de los pacientes cirróticos, un subgrupo experimenta un deterioro de su cirrosis subyacente, llamados episodios de descompensación, que generalmente requieren ingreso hospitalario. En el 30% de estos pacientes, la situación clínica se deteriora aún más y se produce insuficiencia hepática aguda sobre crónica (ACLF). La progresión de la descompensación a ACLF se refleja en una activación extensa de la inflamación sistémica, que afecta a muchas citocinas y sistemas inflamatorios. Es probable que la translocación bacteriana provoque este estallido de inflamación. La mayoría de las veces, la descompensación y el ACLF se desarrollan sin eventos precipitantes identificables, lo que sugiere que están involucrados mecanismos endógenos, por ejemplo, la translocación de bacterias perjudiciales.

Interacciones intestino-hígado actualmente conocidas y sugeridas en la cirrosis. La barrera epitelial deteriorada ("intestino permeable") permite que las bacterias o productos bacterianos (metabolitos) se trasladen a la circulación sanguínea y lleguen al hígado. Allí, interactúan con las células inmunitarias y las células hepáticas circulantes y residentes. Simultáneamente, los ácidos biliares y otras moléculas (p. Ej., Péptidos antibacterianos) que se originan en el hígado arbitran entre la microbiota hepática y intestinal.
-
- Integración de datos clínicos, de laboratorio, microbioma y multiómicos existentes de 12 cohortes, combinando más de 200.000 puntos de datos de más de 10.000 sujetos
- Desarrollo de pruebas basadas en el microbioma para una mejor estratificación de los pacientes con cirrosis que conducen a una predicción y prevención personalizadas de la descompensación y ACLF y una asignación más personalizada al tratamiento.
- Validación de nuevos marcadores basados en el microbioma en un ensayo clínico para permitir la predicción de la respuesta y, por lo tanto, la optimización del tratamiento con rifaximina o albúmina.
- Diseño de nanobiosensores modernos y eficaces como herramientas clínicas útiles para establecer las bases de una terapia personalizada
- Participación de los principales especialistas mundiales en microbioma, líderes tecnológicos y expertos clínicos para la excelencia científica, la Asociación Europea de Pacientes del Hígado (ELPA) y la Asociación Europea para el Estudio del Hígado (EASL)
-
- Especificidad mejorada de las herramientas de diagnóstico
- Mejor predicción y por lo tanto prevención de la descompensación y ACLF
- Estratificar y personalizar el tratamiento de la cirrosis hepática descompensada y ACLF
- Aumento de la supervivencia y disminución de la carga sanitaria asistencial
- Nuevos enfoques diagnósticos y terapéuticos para estimular la innovación en la industria sanitaria europea

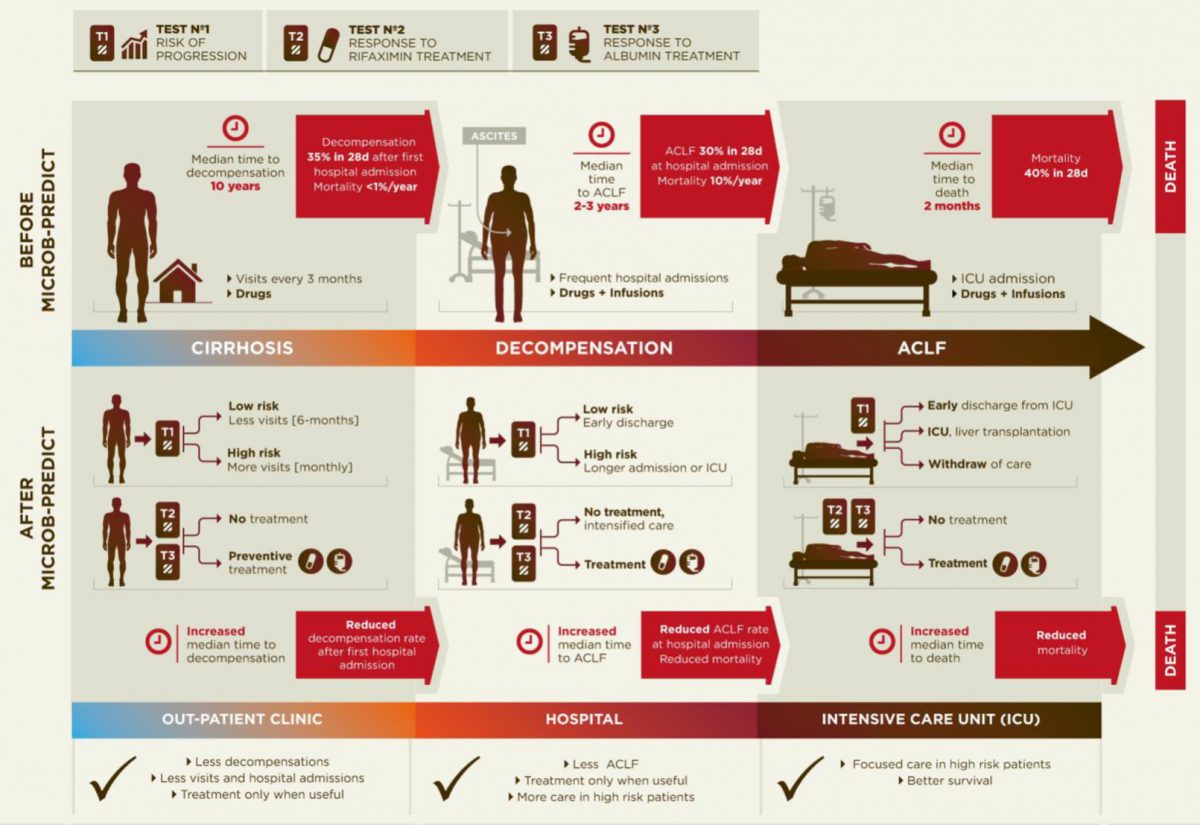
Diagrama de la progresión actual de la enfermedad (panel superior) comparado con la medicina personalizada aplicando los resultados de MICROB-PREDICT (panel inferior).
-
Cirrose wordt soms eindstadium leverziekte genoemd. Dat betekent dat het optreedt na beschadiging van de lever, bijvoorbeeld door ontsteking (hepatitis), vetophoping (steatosis) en verlittekening van de lever (fibrose). Leverschade kan onder meer worden veroorzaakt door infecties, overmatig alcoholgebruik, een verstoorde vetstofwisseling en/of suikerstofwisseling in de lever, waardoor vet zich ophoopt in de levercellen en vele andere oorzaken. Het is heel belangrijk om beschadiging aan de lever te voorkomen en er alles aan toe doen om de lever gezond te houden.
Cirrose wordt ingedeeld in gecompenseerde en gedecompenseerde levercirrose. Bij gecompenseerde levercirrose kan de lever compenseren voor de opgelopen schade aan de lever en de belangrijkste functies blijven uitoefenen.. Veel personen met gecompenseerde levercirrose voelen zich vrij goed en zij kunnen vaak nog vele jaren lever zonder bijvoorbeeld een levertransplantatie nodig te hebben. De lever kan, ondanks aanwezige beschadiging, nog vrij lang relatief goed functioneren, totdat een bepaald punt wordt bereikt dat de lever in functie wel achteruit gaat. Doorgaande beschadiging van de lever kan dan leiden tot ernstige ziekteverschijnselen en zelfs overlijden. Bij gedecompenseerde levercirrose is de lever niet meer in staat om alle functies normaal uit te voeren. Mensen met gedecompenseerde levercirrose hebben vaak veel klachten en hinder hiervan en zij kunnen ernstige complicaties van de cirrose ontwikkelen, zoals een hoge druk in de poortader (hoge bloeddruk in het bloedvatsysteem wat door de lever loopt), bloedende slokdarmspataders (levensbedreigende bloedingen uit de slokdarm of maag), ascites (vrij vocht in de buikholte), ernstige infecties, hepatische encephalopathie (een stoornis in de hersenen doordat bepaalde gifstoffen de hersenen binnendringen door een tekortschietende ontgiftingsfunctie van de lever). Eventueel kunnen deze complicaties leiden tot acuut-op-chronisch leverfalen, met falen van één of meerdere organen en kans op overlijden.

Het ontstaan van gedecompenseerde levercirrose en de voortschrijding naar acuut-op-chronisch leverfalen (ACLF).
-
Het darm-microbioom is de grootste verzameling van genetisch materiaal in het menselijk lichaam. Het heeft een zeer grote metabole activiteit. De meeste micro-organismen leven in symbiose met het menselijk lichaam. Dat betekent dat wij hen nodig hebben om ons voedsel goed te verteren en op te nemen. Elk mens huisvest tenminste 4 x 1013 levende microbiële cellen. In normale (gezonde) omstandigheden, regelt de mens, de gastheer van deze micro-organismen, heel nauw het microbioom. De verdeling, samenstelling en activiteit worden geregeld door de uitscheiding van galzure zouten en antibacteriële eiwitten. Dit zorgt ervoor dat er een goede balans van ‘precies genoeg micro-organismen’ is. Er zijn veel aanwijzingen dat veranderingen in het microbioom het ziektebeloop van chronische leverziekten kunnen beïnvloeden. Daarnaast zijn er grote veranderingen in het darm-microbioom van mensen met levercirrose, het eindstadium van veel chronische leverziekten, ten opzichte van gezonde personen. De onderliggende mechanismen zijn echter nog niet opgehelderd.
Bij cirrose raakt de slijmvlieslaag van de darm beschadigd. Dit heeft tot gevolg dat de darm ‘lek’ is. Dit betekent dat bacteriën en hun produkten de bloedsomloop via de poortader in kunnen komen (dit proces heet bacteriële translokatie). Daar kunnen de bacteriën en hun produkten inwerken op afweercellen, bloedvatcellen, de lever bereiken en daar inwerken op levercellen. Een deel van de personen met cirrose zal hierbij verslechtering van de leverfunctie doormaken, waarbij veelal ziekenhuisopname noodzakelijk is. Bij 30% van deze personen zal de situatie nog verder verslechteren en zij kunnen acuut op chronisch leverfalen (ACLF) ontwikkelen. Bij de voortschrijding van gedecompenseerde cirrose naar ACLF is er een zeer uitgebreide ontstekingsreactie in het lichaam. Zeer waarschijnlijk leidt de bacteriële translokatie tot deze ernstige ontstekingsreactie. Vaak ontstaan gedecompenseerde cirrose en ACLF zonder dat er een duidelijke uitlokkende factor is, waardoor het waarschijnlijk is dat inwendige processen, zoals het binnendringen van schadelijke produkten van bacteriën, hierbij betrokken zijn.

Bekende wisselwerkingen tussen de darm en de lever bij cirrose. Door de verminderde barrièrefunctie van de darm (‘lekke darm’) kunnen bacteriën en hun produkten in de bloedsomloop terecht komen en de lever bereiken. Daar zullen ze inwerken op afweerstoffen en levercellen. Tegelijkertijd beïnvloeden galzuren en andere stofjes zoals bacteriële eiwitten de wisselwerking tussen de lever en het darm-microbioom.
-
- Integratie van bestaande klinische, laboratorium, microbioom en multiomcs gegevens van 12 patiëntencohorten, waardoor meer dan 200,000 data punten van meer dan 10,000 personen worden gecombineerd
- De ontwikkeling van microbioom-gebaseerde tests voor het beter overspellen van de prognose van patiënten en om gepersonaliseerde behandeling van gedecompenseerde cirrose en ACLF mogelijk te maken
- Het onderzoeken van de nieuwe microbioom-gebaseerde biomarker in een klinisch onderzoek om daarmee het effect van de behandeling met rifaximin of albumin te voorspellen en daarmee deze behandelingen te verbeteren
- De ontwikkeling van moderne, effectieve nanobiosensors (apparaten voor het opsporen van bepaalde moleculen) om in te zetten bij de behandeling van patiënten voor zogenaamde gepersonaliseerde behandeling
- Betrokkenheid van top microbioom specialisten uit de hele wereld, technologie leiders en medische experts voor wetenschappelijke excellentie, de Europese Leverpatiëntenvereniging (European Liver Patients Association, ELPA) en de Europese Wetenschappelijke Leververeniging (European Association for the study of the Liver, EASL)
-
- Betere diagnostische tests/instrumenten
- Betere voorspelling van de ontwikkeling van gedecompenseerde cirrose en ACLF, waardoor preventieve maatregelen genomen kunnen worden
- Gepersonaliseerde behandeling van gedecompenseerde cirrose en ACLF
- Verbeterde overleving en minder belasting van het gezondheidszorgsysteem
- Nieuwe diagnostische en therapeutische benadering en daarmee stimulatie van het Europese gezondheidszorgsysteem

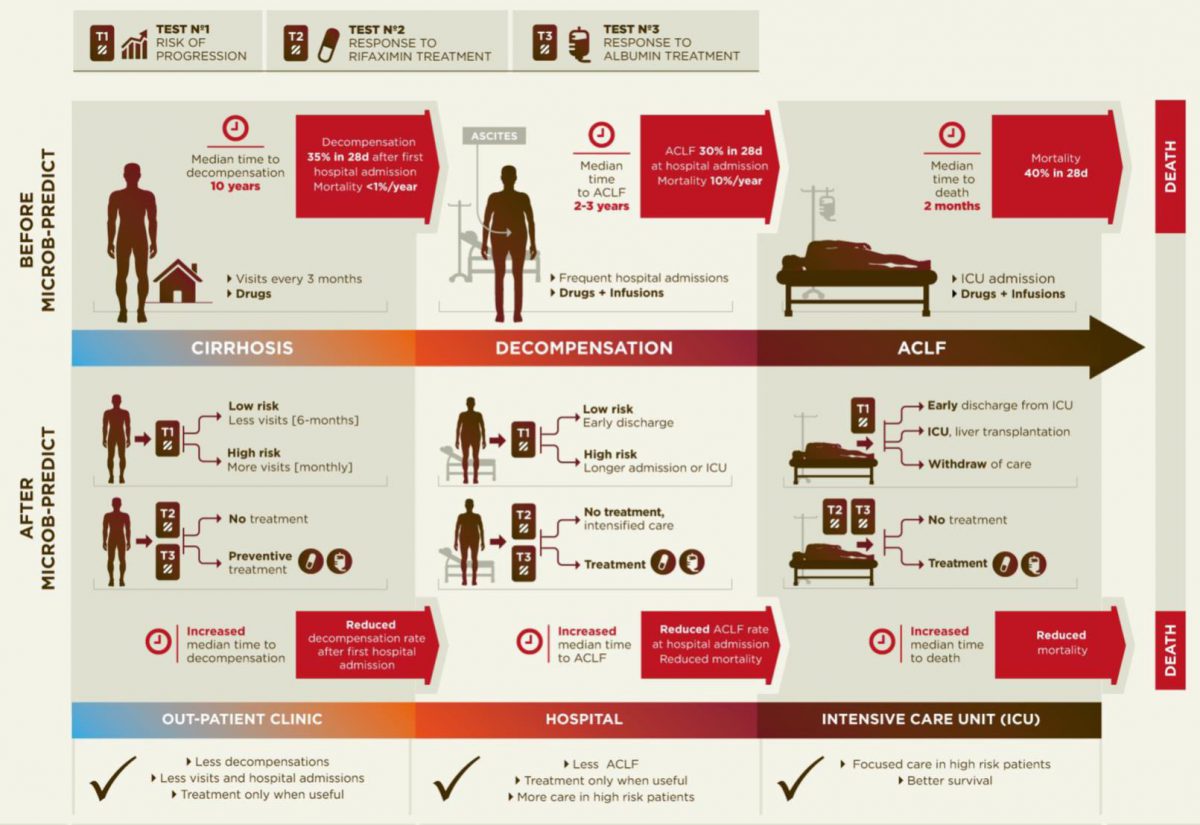
Diagram van de huidige ziekteprogressie (bovenste gedeelte) en van gepersonaliseerde behandeling na toepassing van de resultaten van MICROB-PREDICT (onderste gedeelte)
-
A májcirrózist időnként végstádiumú májbetegségként emlegetik. Egyszerűen ez annyit tesz, hogy a májkárosodás egyéb szakaszai után következik be, melybe beletartozik a gyulladás (hepatitis), zsírlerakódások (szteatózis) a fokozott májkeménység és a máj enyhe hegesedése (fibrózis). Ilyen májkárosodás kialakulhat alkoholizmus, fertőzések, egészségtelen életmód, helytelen táplálkozás vagy étkezési szokások miatt, de bekövetkezhet súlyos sérülés és egyéb okok miatt is. Ezért nagyon fontos, hogy megelőzzük a májkárosodást, és mindent megtegyünk annak érdekében, hogy a máj egészséges és működőképes maradjon. A máj az életet jelenti, és mindkettőből csak egy van.
A májcirrózisnak kompenzált és dekompenzált formáit különböztetjük meg. Kompenzált májcirrózisról akkor beszélünk, amikor a máj dacol a károsodással, és képes megtartani a fontos májfunkciókat. Sok ember éveken keresztül képes elég jól együttélni a kompenzált májcirrózissal anélkül, hogy májtranszplantációra szorulna. Egy bizonyos pontig a máj viszonylag megfelelően tud működni a súlyos májkárosodás ellenére is. De bármilyen további károsodás halálos lehet. Dekompenzált májcirrózisban a máj nem képes minden feladatát megfelelően ellátni. A dekompenzált májcirrózisban szenvedő betegek gyakran szenvednek súlyos tünetek és szövődmények miatt például portális hipertenzió (magas vérnyomás a májon áthaladó érrendszeren belül), varixvérzés (a nyelőcsőben vagy a gyomorban keletkező, életet veszélyeztető vérzés), ascites (a hasban, egész pontosan a peritoneumban meggyűlt folyadék), súlyos fertőzések, enkefalopátia (agyi elégtelenség) miatt, melyek végül krónikus májbetegségre rakódott akut májelégtelenséghez (ACLF-szindróma) vezetnek, melyet többszervi elégtelenség és halál követ.


Pathogenesis of decompensated liver cirrhosis and the progression from decompensation to acute-on-chronic liver failure (ACLF).
-
A bélmikrobiom jelenti a szervezet legnagyobb, nagy anyagcsere-aktivitású genetikai készletét. A mikróbák többsége szimbiózisban él a szervezetünkkel, ami azt jelenti, hogy a tápanyagok megfelelő emésztéséhez és felszívódásához szervezetünknek szüksége van rájuk. Minden emberben legalább 40 milliárd (4 x 1013) élő mikrobiális sejt található. Egészséges körülmények között az ember (itt: gazdatest) az epesav és az antibakteriális peptidek kiválasztásával szorosan szabályozza a bélmikrobiomot, annak eloszlását, összetételét és aktivitását. Ez biztosítja, hogy az „éppen elegendő mikróba” ideális egyensúlya fennmaradjon. Mára elegendő bizonyíték van arra, hogy a mikrobiomban bekövetkező változások módosíthatják, sőt meg is állíthatják a májbetegségek progresszióját, és hogy – az egészséges kontrollcsoporthoz képest – májcirrózisban és a krónikus májbetegségek végső stádiumában szenvedő betegek mikrobiomában lényeges különbségek mutatkoznak. Azonban ennek üteme és pontos mechanizmusa még nincs teljesen feltárva.
Cirrózisban az epitheliális bélbarrier meglehetősen károsodott, ami úgynevezett „szivárgó bélrendszert” eredményez. Ez azt jelenti, hogy így a baktériumok és metabolitjai bejutnak a portális vérkeringésbe (ezt hívjuk bakteriális transzlokációnak), és kölcsönhatásba lépnek az immunsejtekkel, a vaszkuláris sejtekkel, elérik a májat és reakcióba lépnek a máj sejtjeivel, a hepatocitákkal. A cirrózisos betegek egy csoportjánál a cirrózis állapotának romlása, úgynevezett dekompenzációs epizódok jelentkeznek, melyek általában kórházi felvételt igényelnek. Ezen betegek 30%-ánál a klinikai állapot tovább romlik, és krónikus májbetegségre rakódott akut májelégtelenség (ACLF-szindróma) alakul ki. A dekompenzáció és az ACLF-szindróma közötti progresszió szisztémás gyulladás kiterjedt aktivációjában nyilvánul meg, amely számos citokint és gyulladásos mechanizmust érint. Valószínűsíthető, hogy a bakteriális transzlokáció vezet ehhez a gyulladásos fellángoláshoz. A dekompenzáció és az ACLF-szindróma az esetek többségében azonosítható kiváltó események nélkül alakul ki, ami arra utal, hogy endogén mechanizmusok, például káros baktériumok transzlokációja játszik benne szerepet.



Currently known and suggested gut-liver interactions in cirrhosis. Impaired epithelial barrier (“leaky gut”) allows bacteria or bacterial products (metabolites) to translocate into the blood circulation and reach the liver. There, they interact with circulating and resident immune cells and liver cells. Concomitantly, bile acids and other molecules (e.g. antibacterial peptides) originating from the liver arbitrate between liver and gut microbiota.
-
- 12 kohorszból származó meglévő klinikai, laboratóriumi, mikrobiom és multi-omics adatok integrálása, több mint 10 000 beteg több mint 200 000 adatának kombinálásával
- Mikrobiom-alapú tesztek kifejlesztése a cirrózisos betegek jobb stratifikálásához, ami a dekompenzáció és az ACLF személyre szabott előrejelzéséhez és megelőzéséhez, valamint a kezelés személyre szabottabb elosztásához vezethet
- Egy klinikai vizsgálat keretében új mikrobiom-alapú markerek validálása, mely segíti a terápiás válasz predikcióját, s ezzel együtt a rifaximin- vagy albumin-kezelés optimalizálását
- Korszerű, hatékony nanobioszenzorok tervezése, melyek hasznos klinikai eszközök a személyre szabott terápia megalapozásában
- A világ vezető mikrobiom-specialistáink, technológiai vezetőinek és klinikai szakértőinek bevonása, a Májbetegek Európai Szövetségének (ELPA) és az Európai Májkutató Társaság (EASL) részvételével
-
- A diagnosztikai eszközök hatékonyságának javítása
- A dekompenzáció és az ACLF-szindróma jobb előrejelezhetősége és ezáltal hatékonyabb megelőzése
- A dekompenzált májcirrózis és az ACLF-szindróma kezelésének stratifikációja és személyre szabása
- A túlélés esélyének növelése és az egészségügyi terhek csökkentése
- Új diagnosztikai és terápiás megközelítések megjelenése, melyek az európai egészségügyi ágazat fejlődését szolgálják



Diagram of the current disease progression (upper panel) versus personalized medicine applying the results from MICROB-PREDICT (lower panel).
-
Skrumpelever kaldes undertiden slutstadiet af leversygdom. Dette betyder simpelthen, at det opstår efter andre stadier af leverskade, som kan omfatte betændelse (hepatitis), fedt aflejringer (steatose) og øget stivhed samt mild ardannelse i leveren (fibrose). Sådanne leverskader kan skyldes alkoholisme, infektioner, usund livsstil, dårlig ernæring eller spisevaner, alvorlig skade eller andre årsager. Derfor er det vigtigt at undgå leverskader i første omgang og gøre alt for at holde sin lever sund og funktionel. Lever betyder liv, og du har kun en af hver!
Skrumpelever inddeles i kompenseret eller dekompenseret. Kompenseret skrumpelever er, hvor leveren klarer skaden og opretholder sine vigtige funktioner. Mange mennesker med kompenseret skrumpelever føler sig godt tilpas og kan leve i mange år uden behov for levertransplantation. Indtil et bestemt tidspunkt kan leveren fungere relativt godt, selv når den er alvorligt beskadiget. Enhver yderligere skade på leveren kan dog være dødelig. I dekompenseret skrumpelever er leveren ikke i stand til at udføre alle sine funktioner tilstrækkeligt. Mennesker med dekompenseret skrumpelever lider ofte af alvorlige symptomer og komplikationer såsom portalhypertension (højt blodtryk i karsystemet, der bevæger sig gennem leveren), blødende varicer (livstruende blødninger fra blodkar i spiserøret eller mavensækken), ascites (ophobning af væske i bughulen), svære infektioner, encefalopati (hjernesvigt), hvilket til sidst fører til akut-på-kronisk leversvigt (ACLF), efterfulgt af multiorgansvigt og død.

Sygdomsforklaringer i dekompenseret skrumpelever og udviklingen fra dekompenseret skrumpelever til akut-på-kronisk leversvigt (ACLF).
-
Tarmmikrobiomet repræsenterer den største samling af genetisk materiale i kroppen med høj metabolisk aktivitet. De fleste mikrober lever i symbiose med vores krop, hvilket betyder, at vi har brug for dem for at hjælpe os med at fordøje og absorbere vores mad ordentligt. Hvert menneske huser mindst 40 milliarder (4 x 1013) levende mikrobiom celler. Under sunde forhold regulerer mennesket (her også kaldet “værten”) tarmmikrobiomet, dets fordeling, sammensætning og aktivitet ved sekretion af galdesyrer og antibakterielle peptider. Dette sikrer, at der opretholdes en ideel balance i antallet af mikrober. På nuværende tidspunkt er der tilstrækkelig dokumentation for, at ændringer i mikrobiom kan ændre og endda stoppe progressionen af leversygdom, og at der – sammenlignet med raske personer – er store forskelle i mikrobiomet hos skrumpelever patienter, det sidste stadie for kroniske leversygdomme. Imidlertid er dynamikker og mekanismer endnu ikke fuldt udforsket.
I skrumpelever er tarmens epitelbarriere blevet beskadiget, hvilket resulterer i en såkaldt ”utæt tarm”. Dette betyder, at bakterier og deres produkter kan komme ind i portavenen (en proces kaldet ”bakteriel translokation”) for at interagere med immunceller, interagere med vaskulære celler, nå leveren og interagere med leverceller (hepatocytter). Hos skrumpelever patienter oplever en undergruppe forværring af deres underliggende sygdom, kaldet dekompensering, der normalt kræver hospitalsindlæggelse. Hos 30% af disse patienter forværres den kliniske situation yderligere, og der opstår akut-på-kronisk leversvigt (ACLF). Forløbet fra dekompensation til ACLF afspejles i en omfattende aktivering af systemisk inflammation, der påvirker cytokiner og inflammatoriske systemer. Det er sandsynligt, at den bakterielle translokation fører til dette udbrud af betændelse. Oftere end ikke, vil dekompensation og ACLF udvikles uden identificerbare forudgående hændelser, hvilket antyder, at endogene mekanismer, f.eks. translokation af skadelige bakterier er involveret.

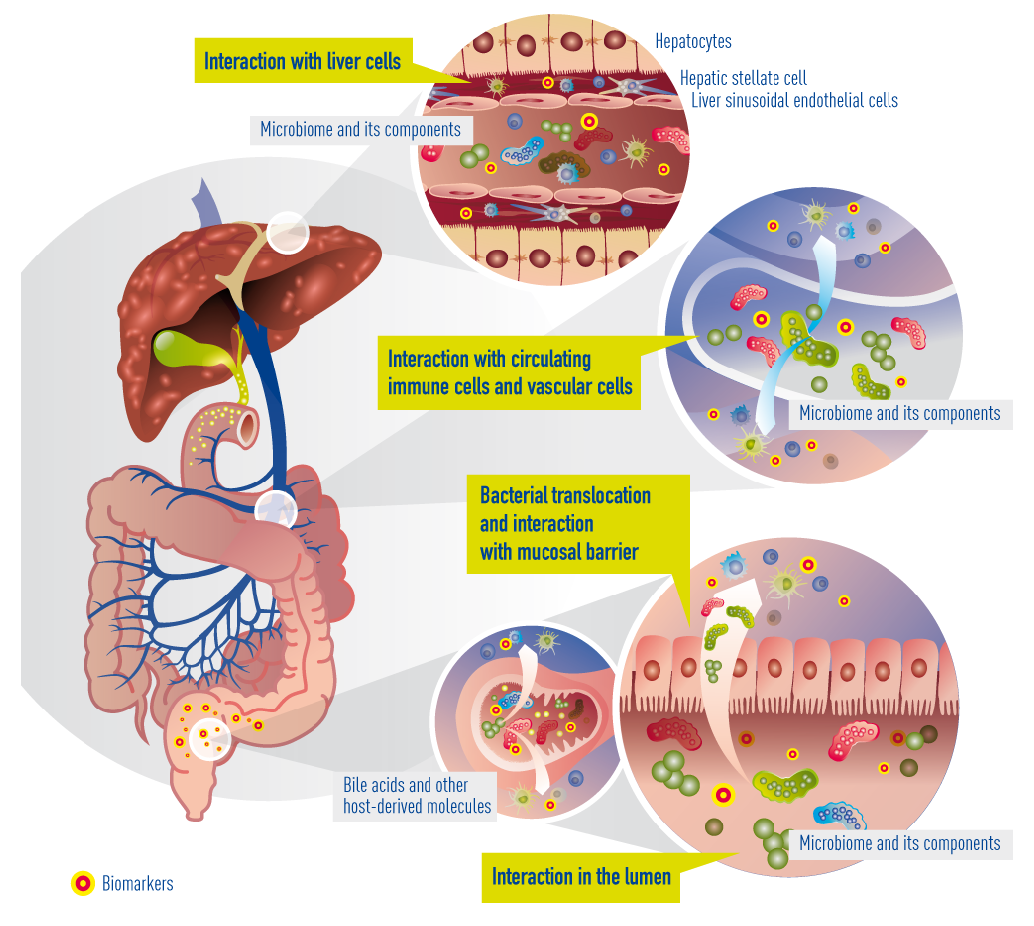
Aktuelt kendte og foreslåede tarm-lever-interaktioner i skrumpelever. Nedsat epitelbarriere ("utæt tarm") gør det muligt for bakterier og bakterielle produkter (metabolitter) at translokere til blodcirkulationen og nå leveren. Her interagerer de med cirkulerende og residente immunceller og leverceller. Samtidig vil galdesyrer og andre molekyler (f.eks. antibakterielle peptider), der stammer fra leveren, kommunikere mellem lever og tarmmikrobiota.
-
- Integration af eksisterende kliniske data, laboratorie-, mikrobiom- og multi-omics-data fra 12 kohorter, der kombinerer mere end 200.000 datapunkter fra mere end 10.000 forsøgspersoner
- Udvikling af mikrobiom-baseret tests til bedre stratificering af skrumpelever-patienter, der fører til personlig forudsigelse og forebyggelse af dekompensation og ACLF samt en mere personlig tildeling af behandling
- Validering af nye mikrobiom-baserede markører i et klinisk studie for at muliggøre forudsigelse af respons og derved optimering af rifaximin- eller albuminbehandling
- Design af moderne, effektive nanobiosensorer som nyttige kliniske værktøjer til at danne grundlaget for personlig behandling
- Involvering af verdensledende mikrobiom-specialister, teknologiledere og kliniske eksperter inden for videnskabelig ekspertise, European Liver Patients Association (ELPA) og European Association for study of the Liver (EASL)
-
- Forbedret specificitet af diagnostiske værktøjer
- Bedre forudsigelse og derved forebyggelse af dekompensation og ACLF
- Stratificering og personalisering af behandlingen af dekompenseret skrumpelever og ACLF
- Øget overlevelse og nedsat byrde i sundhedsvæsenet
- Nye diagnostiske og terapeutiske tilgange til at stimulere innovation i den europæiske sundhedsindustri

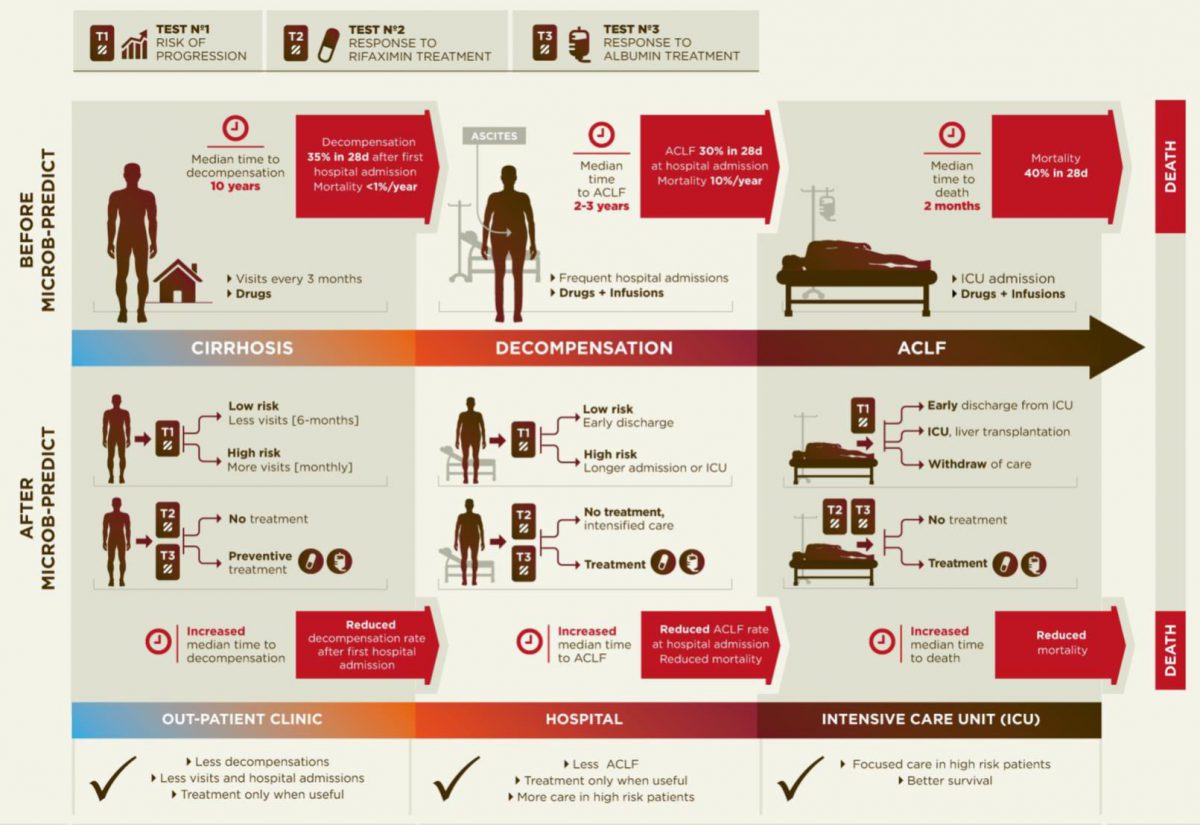
Diagram over den aktuelle sygdomsprogression (øverste del) og personlig medicin, der anvender resultaterne fra MICROB-PREDICT (nederste de).